胶质瘤是中枢神经系统最常见的恶性肿瘤,占所有脑肿瘤的80%。传统"同病同治"的模式面临巨大挑战:低级别胶质瘤患者5年生存率可达70%,而胶质母细胞瘤(GBM)中位生存期仅14.6个月。这种差异源于胶质瘤高度异质性的分子特征。2021年WHO中枢神经系统肿瘤分类首次将分子检测作为诊断金标准,标志着胶质瘤诊疗进入"分子导航时代"。
一、诊断革命:从形态学到分子分型
1.1 传统病理的局限性
过去,胶质瘤诊断依赖显微镜下的细胞形态学特征,但存在显著缺陷:
诊断主观性:不同病理医师对"间变特征"的判断差异率达20%;预后预测失效:相同组织学分级的肿瘤,患者生存期可能相差。数倍;治疗指导缺失:无法区分需要强化治疗的高危低级别肿瘤。
1.2 核心分子标志物解析
1.2.1 IDH突变:胶质瘤的"基因身份证"
生物学意义:异柠檬酸脱氢酶(IDH)突变导致2-羟基戊二酸蓄积,引发表观遗传学重编程。
临床价值:
IDH突变型胶质瘤(占70%低级别、10%GBM)中位生存期延长2-3倍;2021WHO分类将"IDH野生型GBM"更名为"胶质母细胞瘤,NOS";1.2.2 1p/19q共缺失:少突胶质瘤的"分子指纹"。
检测方法:荧光原位杂交(FISH)或染色体微阵列。
治疗意义:
1p/19q共缺失患者对替莫唑胺+放疗的响应率达80%;2016WHO首次将"少突胶质细胞瘤,IDH突变型且1p/19q共缺失"列为独立亚型。
1.2.3 MGMT启动子甲基化:化疗敏感性的"开关"
作用机制:MGMT蛋白修复化疗引起的DNA损伤,其启动子甲基化导致蛋白表达缺失。
临床应用:MGMT甲基化患者接受替莫唑胺治疗,生存期延长4.2个月;2023NCCN指南将其列为GBM患者标准检测项目。
二、治疗决策:从"一刀切"到"量体裁衣"
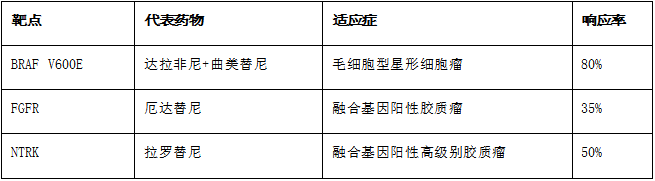
2.1 靶向治疗:精准打击驱动基因
2.2 免疫治疗:激活肿瘤微环境
2.2.1 免疫检查点抑制剂
帕博利珠单抗:KEYNOTE-028研究显示,PD-L1阳性复发胶质瘤患者6个月PFS率达25%;联合治疗策略:替莫唑胺+PD-1抑制剂使MGMT甲基化患者中位OS突破20个月。
2.2.2 肿瘤疫苗
个性化新抗原疫苗:哈佛医学院开发的NeoVax疫苗,在GBM患者中引发特异性T细胞应答率达80%;树突状细胞疫苗:DCVax-L III期试验显示,联合治疗组5年生存率达13%,显著高于对照组5%。
2.3 电场治疗:物理疗法的"精准制导"
作用机制:200kHz交变电场干扰癌细胞有丝分裂。
临床数据:EF-14试验证实,联合电场治疗使GBM患者中位OS延长至20.9个月;2020NCCN指南将其列为新诊断GBM的一线治疗。
三、预后评估:动态监测的"分子晴雨表"
3.1 液体活检:实时监测肿瘤进化
ctDNA检测:通过脑脊液或血液检测IDH突变、EGFR扩增等,灵敏度达75%
临床应用场景:术后ctDNA阳性提示残留病灶,复发风险增加3倍;治疗期间ctDNA动态变化预测耐药发生,较影像学提前8-12周。
3.2 多组学联合分析:构建生存预测模型
基因组+表观组:整合IDH突变、MGMT甲基化、TERT启动子突变,构建4基因预后评分系统;临床验证:该模型将低级别胶质瘤10年死亡风险预测准确率提升至85%。
四、未来展望:从精准诊疗到治愈突破
4.1 人工智能辅助诊断
病理AI系统:谷歌开发的DeepPath算法,识别胶质瘤分子亚型的准确率达92%;影像组学:基于MRI的纹理分析预测IDH突变状态,AUC值达0.89。
4.2 基因编辑技术
CRISPR筛选:发现CDK4/6抑制剂可增强胶质瘤放疗敏感性,III期试验正在进行;CAR-T细胞治疗:靶向EGFRvⅢ的CAR-T细胞在复发GBM中展现抗肿瘤活性,I期试验客观缓解率达30%。
4.3 类器官技术
患者来源类器官(PDO):体外培养的胶质瘤类器官可保留原始肿瘤的分子特征和药物敏感性;应用前景:PDO药敏试验使患者获得客观缓解的概率从30%提升至65%。
五、结语:分子检测照亮治愈之路
基因检测正在重塑胶质瘤的诊疗范式:从诊断时的"分子分型",到治疗时的"靶向选择",再到预后评估的"动态监测",每个环节都因分子检测而更加精准。尽管挑战犹存(如肿瘤异质性、耐药机制),但随着多组学技术的融合和人工智能的赋能,我们正朝着"治愈胶质瘤"的终极目标稳步迈进。
(刘莲勤 河南省人民医院 病理科)



