肺癌作为全球发病率和死亡率最高的恶性肿瘤,每年夺走超过180万人的生命。在医学界,它被称为"最狡猾的癌王"——早期症状隐匿,超过70%的患者确诊时已处于中晚期。但近年来,分子病理学的突破性进展正在改写这个局面,通过解码癌变背后的"分子密码",掌握了精准打击癌细胞的利器。
一、基因突变:癌变的"元凶密码"
1.1 驱动基因的"叛变"
正常细胞的生长遵循精密的基因调控,而肺癌的发生源于关键基因的突变。这些突变如同细胞内部的"叛乱分子",使细胞获得无限增殖能力:
EGFR基因突变:亚洲非小细胞肺癌患者中,40%-50%存在表皮生长因子受体(EGFR)突变。这类突变如同给细胞安装了"永动机",第19外显子缺失和第21外显子L858R点突变是最常见的"叛乱代码"。
ALK融合基因:5%-7%的肺癌患者存在间变性淋巴瘤激酶(ALK)基因重排,EML4-ALK融合最为常见,这类突变被称为"钻石突变",因靶向治疗效果极佳。
KRAS突变:西方患者中30%的肺腺癌携带KRAS突变,其中G12C亚型占比40%,这类突变如同细胞信号系统的"卡死开关"。
1.2 突变检测的"金标准"
现代病理诊断已从形态学观察升级为分子检测:
二代测序(NGS):可一次性检测400+个癌症相关基因,如同给癌细胞做"全基因组扫描"。
液体活检:通过检测血液中的循环肿瘤DNA(ctDNA),实现无创、动态的突变监测。
二、分子分型:肺癌的"精准画像"
2.1 组织学分型的局限
传统病理通过显微镜观察细胞形态将肺癌分为腺癌、鳞癌等类型,但分子分型揭示了更深刻的疾病本质:
腺癌:90%携带EGFR/ALK/ROS1等驱动基因突变,如同携带"特定导航系统"的癌细胞。
鳞癌:FGFR1扩增和DDR2突变更常见,治疗策略需"因地制宜"。
小细胞肺癌:99%存在TP53和RB1基因失活,如同失去"刹车系统"的疯狂复制机。
2.2 免疫分型的新维度
免疫检查点抑制剂(ICI)的兴起催生了免疫分型:
PD-L1表达:≥50%的高表达患者,免疫治疗有效率可达40%-50%。
肿瘤突变负荷(TMB):TMB≥10mut/Mb的患者,免疫治疗生存获益更显著。
三、靶向治疗:精准打击的"分子导弹"
3.1 经典靶向药物进化史
3.2 耐药突变的"攻防战"
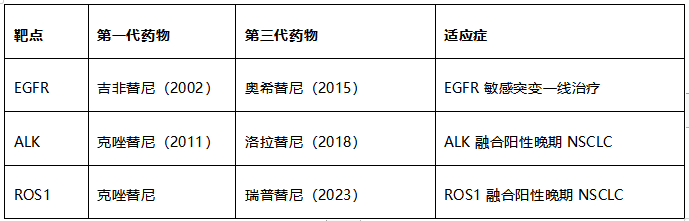
靶向治疗面临的最大挑战是耐药性:
EGFR T790M突变:50%的患者在服用第一代药物后出现该耐药突变,第三代药物奥希替尼可精准抑制。
ALK耐药突变:洛拉替尼可覆盖G1202R等复合突变,被誉为"ALK耐药最后的堡垒"。
四、免疫治疗:激活自身抗癌力
4.1 PD-1/PD-L1抑制剂的革命
帕博利珠单抗:KEYNOTE-042研究显示,PD-L1≥50%的患者5年生存率达31.9%。
卡瑞利珠单抗:CameL研究证实,联合化疗可使晚期患者中位生存期达27.9个月。
4.2 免疫联合治疗的"1+1>2"效应
靶向+免疫:奥希替尼联合PD-1抑制剂,可使EGFR突变患者PFS延长至18.1个月。
双免疫联合:纳武利尤单抗+伊匹木单抗,在PD-L1阴性患者中仍显示生存获益。
五、预防与早期筛查:抓住"黄金窗口期"
5.1 高危人群的"筛查三剑客"
低剂量螺旋CT:可发现直径<5mm的微小结节,5年生存率比X光片高4-13倍。
肿瘤标志物组合:CEA+CYFRA21-1+ProGRP联合检测,灵敏度提升至72.3%。
基因检测:携带EGFR/ALK突变的高危人群,需每3-6个月进行ctDNA监测。
5.2 生活方式"防癌指南"
戒烟:吸烟者肺癌风险是不吸烟者的10-20倍,戒烟10年后风险可降低50%。
空气防护:PM2.5每增加10μg/m³,肺癌风险上升8%。
饮食干预:十字花科蔬菜(如西兰花)中的萝卜硫素可抑制癌细胞生长。
六、未来展望:破解癌变的终极密码
6.1 个性化肿瘤疫苗
mRNA疫苗:根据患者突变基因定制,如Moderna的mRNA-4157疫苗,可使黑色素瘤复发风险降低44%。
新抗原疫苗:利用患者自身肿瘤特异抗原,激活精准免疫应答。
6.2 人工智能的"病理革命"
AI病理诊断:谷歌开发的LYNA算法,可准确识别淋巴结转移,灵敏度达99%。
治疗预测模型:华中农业大学团队建立的4D耐药模型,可提前6个月预测靶向治疗失效。
结语:从"盲人摸象"到"精准制导"
肺癌治疗已进入"分子导航"时代,通过解码癌变密码,我们实现了从"一刀切"治疗到"量体裁衣"的跨越。但这场战役远未结束——每100名肺癌患者中,仍有约30人缺乏可靶向的驱动基因。未来,随着单细胞测序、空间组学等技术的突破,人类终将彻底解开癌变的终极密码。
(张新伟 河南省人民医院 病理科)



